男性拥有生殖能力的代价是什么?更易患癌!

雄激素能维持雄性的生育能力和第二性征,但它同时也让男性患大多数肿瘤和因肿瘤而死的风险增加了。
撰文 | clefable
审校 | 李诗源
第2条X染色体
在遗传上,男性和女性最基础的差异是1条性染色体。男性拥有的一条Y染色体有着极其关键的sry基因,能表达睾丸决定因子(testis determining factor)。这种蛋白质让男性发育出睾丸等生殖器官。而睾丸能表达睾酮等雄激素,继续促进男性发育出完整的第二性征,拥有繁殖后代的能力。
Y染色体将人类划分出了性别,那女性的第2条X染色体,有什么作用呢?答案可能是,没用。1995年,英国遗传学家Mary Lyon提出了X染色体去激活(X-inactivation)理论。也就是说,在雌性体内,一条X染色体会处于永久失活的状态,以此避免雌性X染色体上基因的表达量是男性的2倍,引发潜在的问题。比如,X染色体上有很多和免疫相关的基因,如果2条X染色体上的这些基因都表达,照理说女性的免疫力会远强于男性。
然而从已知的现象来看,女性的先天性免疫和获得性免疫能力都比男性更强。排除和性别特别相关的癌症,男性患上每一种癌症的风险都更高,而且因各种恶性肿瘤而死的总体风险大约是女性的2倍。最明显的当属膀胱癌了,当排除掉吸烟、职业和尿路污染等已知的影响因素后,男性患这种癌症的风险仍然是女性的3~4倍。
雄性更易患癌
在科学家看来,这非常不合理。那导致这种现象的原因是什么呢?首先在哺乳动物中,人类属于胎盘哺乳动物。这类哺乳动物有一个很明显的特征,就是在细胞中哪一条X染色体去激活是不确定的,例如,在A细胞和B细胞中失活的可能分别是来自母亲和父亲的X染色体。而在其他动物,例如袋鼠、考拉等有袋类动物中,失活的永远是来自父本的X染色体。

考虑到在任意一条X染色体上都可能有基因由于一些原因而失活,而女性有2条X染色体,可以相互补充,而男性只有一条,那么折算下来,女性X染色体上表达的基因就可能比男性多。另外,一些科学家还发现,一些基因能逃脱X染色体去激活。换句话说,虽然有一条X染色体被弃置了,但其上仍然有一些基因能表达。综上,仅在X染色体上,女性有大约15%的基因的表达量都会比男性更高。
但是,这些可能只是导致男性更易患癌的一部分原因。根据近期《科学·免疫学》发表的一项新研究,由男性生殖器官分泌的雄激素(最常见的是睾酮),可能会全面削弱男性抵抗各种肿瘤的能力(这里需要排除掉性别特异性癌症)。在人体内,除了男性生殖器官之外,肾上腺皮质网状带和卵巢也会分泌少量的雄激素,一般来说男性体内(10-35 nmol/L)的雄激素水平约为女性(0.5-2.4 nmol/L)的10~20倍。在小鼠等动物中,雄性和雌性体内的雄激素水平也存在类似的差异。
在新研究中,美国俄亥俄州立大学和哈佛大学医学院的科学家研究了患膀胱癌的小鼠。这些小鼠通常会出现排尿疼痛和尿血等症状。他们首先观察到,尽管雌鼠和雄鼠膀胱中DNA的突变情况相似,但雄鼠发生癌症的概率以及癌症死亡率都更高。科学家推测,可能是因为雄鼠的免疫能力更低。他们进一步发现,如果雄鼠和雌鼠体内都缺乏T细胞,那么雌鼠和雄鼠的抑癌能力不会有差异。由此可见,这种差异是由于T细胞导致的。
抗癌T细胞的衰竭
在人体内,抗癌的T细胞主要有CD8 T细胞和CD4 T细胞。前者会杀死被病毒感染的细胞、癌细胞,而后者会激活B细胞和CD8 T细胞,引发广泛的免疫反应。在实验中,当用抗体中和掉CD8 T细胞后,雄鼠和雌鼠体内的癌症发展会大致相同,但中和掉CD4 T细胞却不会有这样的效果。这也意味着CD8 T细胞可能在雄性和雌性的患癌差异中扮演了重要角色。
一部分CD8 T细胞会继续演变成一种专门杀伤肿瘤的细胞,名为CD8 TLC(也称为CD8 肿瘤浸润性淋巴细胞)。科学家推测,它们在不同性别罹患肿瘤上的差异中,可能具有关键作用。实际上,这种细胞并不能长期维持很强的功能,在肿瘤抗原的不断刺激下,它会进入一种“耗竭”的状态。这是一个动态的过程,CD8 TLC从激活状态到达“祖细胞耗竭”(progenitor exhaustion,PE)状态再到“终末耗竭”(terminal exhaustion,TE)状态,逐渐失去功能,无法再控制癌症的发展。
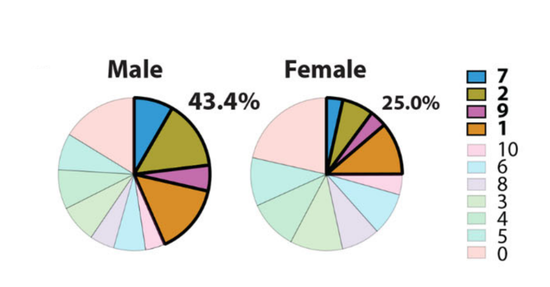
在实验中,研究人员分别从雌鼠和雄鼠体内分离出了近1万个和1.6万多个CD8 T细胞,并根据单细胞测序结果,又将它们分为11个细胞簇,对应的是处于不同分化阶段的CD8 T细胞。其中,1号、2号、7号和9号细胞簇在雄鼠癌症微环境中占比高达43.3%,而在雌鼠体内只占25.0%。
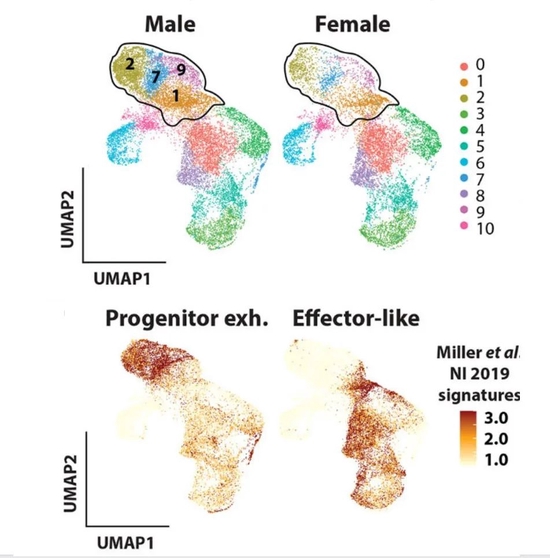
2号、7号细胞簇类似于丧失部分抗肿瘤功能、进入PE状态的CD8 TLC。(图片来源于研究论文)
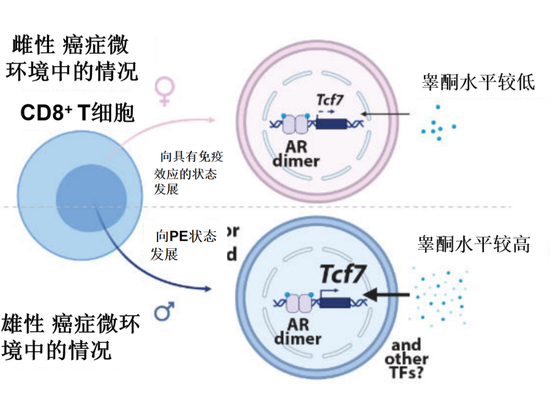
而2号、7号细胞簇十分类似于激活的CD8 TLC耗竭后转变成的PE状态的细胞。这些细胞内会表达一种关键的细胞因子Tcf7,正是它使CD8 T细胞不会转变成CD8 TLC发挥作用,而是直接进入到功能部分缺失的PE状态。随后,这些细胞会进入功能丧失的“终末耗竭”的状态。
雄激素的“罪恶”
但是,为什么雄鼠体内这种耗竭的细胞会更多呢?研究人员又设计了4种老鼠模型,分别是野生的雌鼠、雄鼠以及性转雄鼠(含有XX性染色体,同时常染色体中引入了sry基因)和性转雌鼠(含有XY性染色体,但是sry基因被敲除了),发现雄鼠(包括性转雄鼠)更容易患上膀胱癌,而且不论小鼠的性染色体是怎样的,当其体内的睾酮含量越高时,肿瘤发展得就越快。
为了遏制这种情况,研究人员对雄鼠进行了阉割,以降低其整体的睾酮水平。在3周之后,当雄鼠的睾酮水平降到和雌鼠一样时,它们体内的肿瘤生长开始减慢。在阉割的雄鼠体内,PE状态的CD8 T细胞的占比开始减少,降低到了和雌鼠相当的水平,而更多CD8 TLC开始发挥作用,遏制了癌细胞的发展。实际上,睾酮能通过雄激素受体(AR)信号通路,来让更多的CD8 T细胞进入PE状态和TE状态,进而在雄鼠体内富集。而遏制AR信号通路或者减少睾酮,能减少进入TE状态的CD8 T细胞的数量。
在此前的研究中,科学家也发现了雄激素有抑制免疫系统的能力,例如抑制胸腺内T细胞的发育,T细胞的组织特异性渗透以及效应分化。但这是首次发现雄激素能让CD8 T细胞逐渐进入功能丧失的状态。但科学家也揭示了只要能抑制CD8 T细胞内的AR信号通路,就能避免这种影响。
而在人体内,虽然女性的先天免疫和获得性免疫能力较男性更强,例如女性在接种疫苗后产生的抗体浓度更高,患癌和因癌症而死的概率更低,但这其实也是一把双刃剑。更强大的免疫能力,让更多的女性受到了自身免疫性疾病的困扰,而治愈这类疾病也是一个棘手的难题。
参考链接:
https://www.nature.com/articles/nri.2016.90
https://en.wikipedia.org/wiki/Androgen
https://en.wikipedia.org/wiki/X-inactivation
https://www.frontiersin.org/articles/10.3389/fimmu.2020.622509/full
论文:https://www.science.org/doi/10.1126/sciimmunol.abq2630
本文转自《环球科学》
为什么人类更喜欢狗?因为狗有特殊的“表情肌肉”
狗比狼进化出了更接近人类的面部运动方式,这使狗和人之间能更好地交流,这也可能有助于解释为什么人们觉得狗脸如此吸引人。“与其他家养动物相比,狗的独特之处在于,它们与人类建立了互惠关系,是人们的伙伴。它们通过‘小狗眼神’相互凝视来证明这一点。”美国杜肯大学MadisenOmstead说。诺哈网2023-05-26 01:33:170000“天然木乃伊”保存完整,与居民吃神秘蔬菜有关?
在哥伦比亚一处小镇竟然保存着“天然木乃伊”,这些木乃伊尸体已有100多年历史,不像埃及木乃伊一样,这些尸体都是自然陈放,历经百年仍然保存完整。尸体通常以躺姿摆放,一只胳膊放在另一只胳膊上。该陵墓位于哥伦比亚首都波哥大西南67公里处的安第斯山脉之上,为什么这些遗体会保存得如此完好,仍是一个未解谜团,此前一些专家认为这是因为当地的气候和海拔,可能会对人体产生特殊影响,人们死后就像一个天然防腐者。诺哈网2023-05-26 17:48:500000《科学》封面:癌细胞高清生死实录!或促进新型免疫疗法诞生
▎药明康德内容团队编辑人体由万亿级数量的细胞组成,但无论细胞的形态如何,执行着怎样的功能,它们都有着一个共同的特征,一个由双层磷脂形成的保护性膜结构,其也被称作细胞质膜。质膜可以保护细胞免受环境影响,并且充当细胞内外物质交换的守门人。当质膜承受的压力过大,无论是缺氧、营养匮乏或药物影响,质膜都会产生损伤从而导致细胞死亡。诺哈网2023-05-26 03:47:090000让骁龙888征服《原神》!华为MatePad Air首销:2799元起
快科技5月25日消息,上周华为在夏季发布会上推出了多款新品,其中还有一款极致轻薄史上的新品版——华为MatePadAir。根据华为官方消息,华为MatePadAir在今天正式迎来首销,到手价2799元起。该机最大的亮点就是轻薄便携,整机厚度只有6.4mm,重量也仅有508g,是同档位最轻薄的产品,拿在手上非常轻巧,即便外出携带也不会太过负担。诺哈网2023-05-25 18:48:500000睡前刷手机,问题不大?研究人员追踪了800个年轻人,结果有点意外
晚上睡觉前刷刷手机,可能已经成为很多年轻人的习惯。有一些研究提醒说,睡前频繁刷手机或许不利于健康,比如刷手机时间长了影响入睡,扰乱正常的睡眠模式和生物钟。还有人担心,睡前刷手机会加重负面情绪。事实上,神经科学家确实通过动物实验发现,夜间增加光照,尤其是蓝光照射——手机等电子设备通常发出蓝光,会影响大脑特定的神经环路,从而诱发抑郁相关的症状。诺哈网2023-05-26 20:48:570000







